近日,厦门大学物理系陈虎教授课题组在蛋白质折叠与去折叠动力学领域取得重要进展,相关成果以“Free energy landscape of type III fibronectin domain with identified intermediate state and hierarchical symmetry”为题在线发表于Physical Review Letters上 。
纤维连接蛋白(Fibronectin,FN)是细胞外基质中最重要的蛋白之一,它通过III型纤维连接蛋白的第10个结构域(FNIII10)直接参与并介导细胞的粘附过程。尽管FNIII10具有类似于免疫球蛋白结构域的简单自然结构,但却展现出完全不同的去折叠行为。而且,FNIII10对生理条件的力学响应还没有被详细研究过。
此项工作中,团队通过单分子磁镊技术研究了FNIII10在生理拉力作用下的去折叠和折叠动力学。结果表明FNIII10的折叠和去折叠路径完全一致,并且存在着一个明显的中间状态。通过探索FNIII10三种不同的截断体在不同实验中的表现行为,确定了实验中唯一的中间状态,即FNIII10的A和G链从自然结构中被剥离的状态。
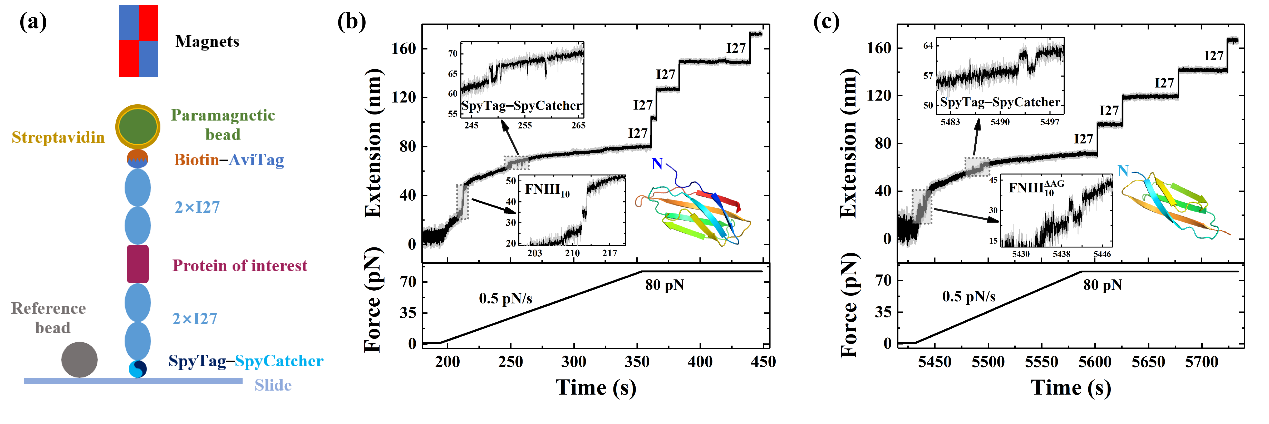
Fig.1 单分子磁镊测量示意图。
此外,研究团队得到了FNIII10在自然状态态、中间态和去折叠态之间所有与力相关的转换速率,但是发现去折叠速率都与贝尔模型有着明显的偏差。我们由此构建了FNIII10定量的自由能景观,其中包含多个明确位置和自由能差的能垒和势阱。该自由能景观呈现出分层对称的模式。

Fig.2 FNIII10的自由能景观图。
研究团队阐明了一种通用方法,即通过转变步长、稳定性和力依赖的转换速率,以最严格的标准识别蛋白质的中间状态。蛋白质中间态的存在与否与其稳定性息息相关。这对于理解蛋白质的热稳定性、中间状态和动力学速率之间的关系非常重要。从物理学角度来看,力和伸长是共轭变量。因此,只有在低作用力下对蛋白质进行测量,才能提供足够大范围伸长的自由能景观信息,这对于研究蛋白质折叠问题至关重要。
该工作在厦门大学物理系陈虎教授的指导下完成,物理系2019级博士研究生孙皓为论文的第一作者,国科温州研究院郭子龙与王洋博士参与了实验设计与分子动力学模拟工作,乐世敏教授参与了数据分析工作。所有作者一并感谢和吴晨旭老师、马锐老师、来访的新加坡国立大学严洁老师和南京大学曹毅老师的有益讨论。该工作得到了国家自然科学基金项目(11874309、12174322)和111引智计划(B16029)的资助。
文章链接:https://link.aps.org/doi/10.1103/PhysRevLett.131.218402